|


Роль регуляторных пептидов в развитии патологической тревоги и других психических расстройств
Комната 425
Регуляторные пептиды (нейропептиды) координируют деятельность всех органов и систем и обеспечивают адаптацию организма к постоянно меняющимся факторам внешней и внутренней среды: поддерживают гомеостаз, воздействуют на иммунные процессы, играют важную роль в механизмах памяти, обучения, формировании эмоций и др. Многие регуляторные пептиды уже используются в медицине как лекарственные средства, а фармакологический потенциал нейропептидов как мишеней для разработки новых лекарств, причём высокоспецифичных, - огромен.
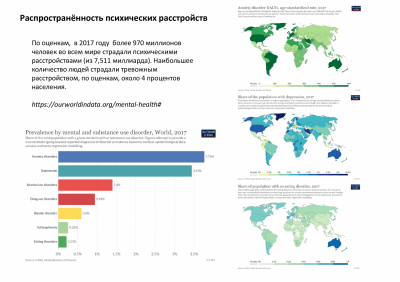
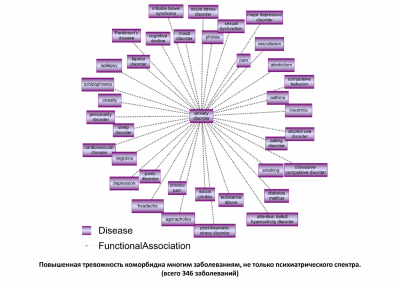
Тревожные и панические расстройства занимают одно из ведущих мест среди социально значимых заболеваний. По оценкам, 284 миллиона человек во всем мире страдают подтверждённым тревожным расстройством. С учётом маскированных форм этих заболеваний, таких как тревожная депрессия, алкоголизм, компульсивные расстройства, соматические расстройства психогенной природы, а также коморбидности другим заболеваниям (например, мигрень и псориаз), их распространённость ещё больше. Паническое расстройство диагностируется у людей, которые испытывают спонтанные, казалось бы, внезапные приступы паники и очень боятся повторения приступа. Панические атаки могут сильно мешать повседневной жизни, заставляя людей пропускать работу, часто посещать врача и избегать ситуаций, в которых они опасаются, что у них может возникнуть паническая атака. Инвалидизация особенно велика, если паническое расстройство сопровождается агорафобией. Раскрытие внутренних нейрохимических механизмов, контролирующих эмоции тревожности и страха, и возможность коррекции патологических проявлений этих состояний является одной из важных проблем физиологии и медицины.
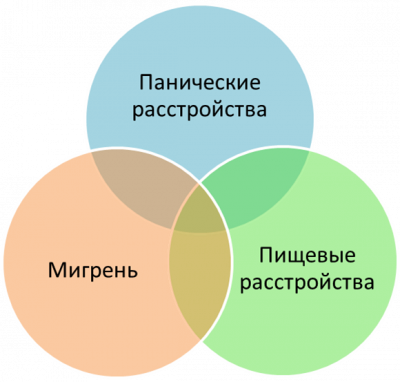
Нарушения пищевого поведения. Во многих исследованиях нарушения пищевого поведения связывают с эмоциональными расстройствами. Известно, что две трети людей с расстройствами пищевого поведения в какой-то момент своей жизни страдают тревожным расстройством и что примерно у половины тревожное или паническое расстройство развилось в детстве, задолго до начала расстройства пищевого поведения. Другой кандидат на объяснение аноректического поведения – депрессия. При анорексии есть целый ряд признаков этого заболевания: снижение настроения, нарушения сна, направленная на себя враждебность, снижение сексуальных потребностей. В свою очередь, анорексия и истощение настолько часто сопровождают депрессию, что считаются одним из облигатных её признаков и включаются в качестве критериев диагностики депрессии практически во все известные опросники. Можно предположить, что в основе и анорексии, и депрессии, и патологической тревоги может лежать какой-то более общий механизм, не вполне одинаково проявляющий себя при этих расстройствах. Мигрень. По данным ВОЗ мигрень является одной из ведущих причин потери трудоспособности, сопоставимой с такими заболеваниями как рак, сахарный диабет, сердечно-сосудистые заболевания и др. Мигрень связана как с депрессией, так и с тревогой. Показано, что более 20% людей, страдающих эпизодической мигренью подвержены депрессии. Сопутствующее тревожное расстройство встречается у 20% людей с эпизодической мигренью и 30-50% людей с хронической головной болью. Общие симптомы тревоги могут совпадать с симптомами мигрени. С другой стороны, сами по себе приступы мигрени могут действовать как стрессор, потенциально приводя к порочному кругу учащения мигрени. Учёные всего мира спорят: мигрень провоцирует тревогу или тревога мигрень? Вопрос не простой, точного ответа на него пока нет. Ясно одно, что таким образом возникает замкнутый порочный круг: тревога и стресс → мигрень → хроническая форма. Терапия пациентов с данным типом головной боли все ещё не достаточно эффективна, следовательно, и уточнение механизмов мигрени и поиск новых мишеней для терапии чрезвычайно актуальны. Следовательно, в развитии таких, казалось бы, разных заболеваний как пищевые расстройства, мигрень и панические расстройства просматривается общая черта – патологическое увеличение уровня тревоги. Нейропептиды – благодаря своим свойствам, локализации и разнообразию – идеальные кандидаты для участия в регуляции процессов, лежащих в основе тревоги и страха.
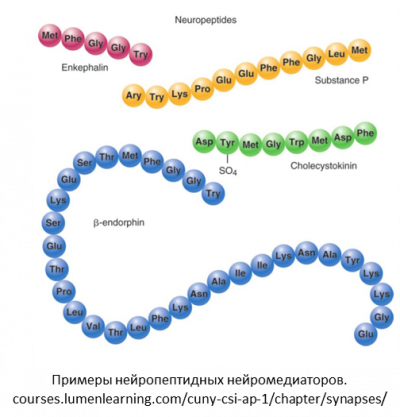
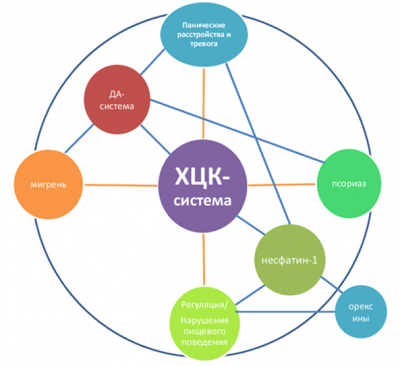
Холецистокининергическая система мозга - среди эндогенных факторов тревожности и страха играет одну из ведущих ролей. Именно изучение роли холецистокининэргической системы в регуляции нарушений эмоциогенной сферы а также её взаимодействия с другими пептидными и иными регуляторными системами, вовлечёнными в развитие этих заболеваний лежит в основе наших исследований. Холецистокининергическая система включает в себя рецепторы холецистокинина 2х подтипов, а также препробелок холецистокинин (CCK) и его продукты: пептиды от 58 до 3 аминокислот. Биологическое действие холецистокинина заключается в модуляции ряда классических нейромедиаторов, включая ГАМК, нейропептиды (несфатин, орексины, грелин и др), эндогенные опиаты и дофамин в мозге. В органах желудочно-кишечного тракта в функцию холецистокинина входит контроль моторики кишечника и модуляция пищевого поведения. Предполагается, что изменения активности ХЦК-ергической системы, такие, как гиперчувствительность рецепторов холецистокинина к внутриклеточным ответам, связанным с этими рецепторами, а также нарушения в обмене холецистокинина, могут быть нейробиологической основой нарушений эмоциогенной сферы при генерализованной тревоге, депрессии и соматоформных проявлений патологической тревоги (например, при псориазе). Холецистокининергическая система - это также потенциальная мишень для исследования мигрени. Орексины – другая группа относительно недавно открытых нейрорегуляторных пептидов, чья функция связана с регуляцией пищевой мотивации и энергетическим гомеостазом. Известно влияние орексинов на уровень сахара в крови, метаболизм в жировых тканях, кровяное давление и овуляцию. Также орексины участвуют в выработке мотивированного поведения и появлении психологической зависимости, вовлечены в процессы взаимодействия нервной и иммунной систем. Предполагается также, что орексины регулируют негативные эмоциональные реакции. Также обсуждается их участие в развитии продромального синдрома при мигрени. Наиболее известная функция орексинов – нейроэндокринная регуляция цикла сна и бодрствования. Несфатин-1 – нейропептид необходимый для распознавания голода и насыщения в организме и оказывающий ключевое влияние на психическую составляющую пищевого поведения. Тесно взаимосвязан с адипонектинами, половыми гормонами и другими регуляторными пептидами. Кроме того, несфатин-1 оказывает плейотропное действие на уровне сердечно-сосудистой и пищеварительной систем, а также играет роль в регуляции стрессовых реакций, поведения, сна и размножения. Рецептор несфатина-1 до сих пор не обнаружен. Предполагается его тесная функциональная связь с холецистокининовой и орексиновой системам.
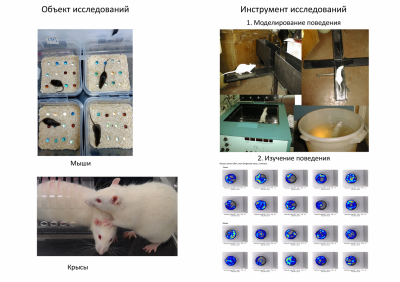
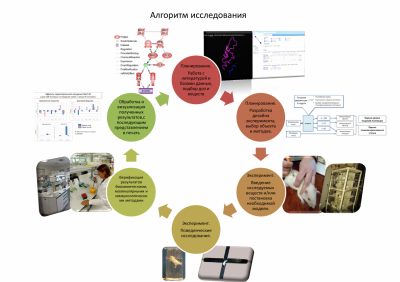
Таким образом, наблюдается определённое функциональное сходство и колокализация трёх пептидных систем, из чего можно предположить, что и несфатин-1, и орексин, и холецистокинины являются частью одного функционально-связанного комплекса и действуют в определённой последовательности и взаимодействии. Однако, до настоящего особенности их взаимодействия и иерархия не известны. Именно они и являются объектом нашего научного интереса. Методы: Для выявления физиологического участия нейропептидов в поведении и эмоциях, на кафедре используются различные подходы. Главные из них сосредоточены на поведенческих эффектах нейропептидов, то есть их влияние на характеристики поведения животных в различных тестах. Объектом исследований являются лабораторные грызуны.
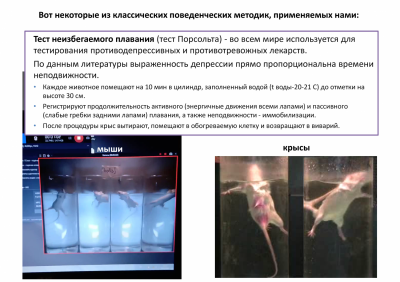
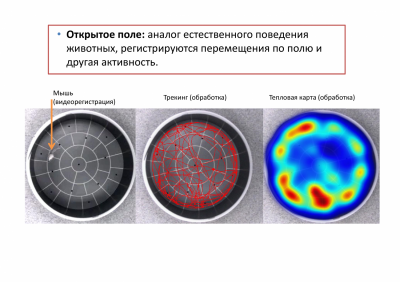
Нами используются классические поведенческие тесты для определения эмоционального статуса животных – приподнятый крестообразный лабиринт, открытое поле, темно-светлая камера, тест неизбегаемого плавания, модель обучения с положительным подкреплением (Y-лабиринт), закапывание шариков, запах хищника и др.
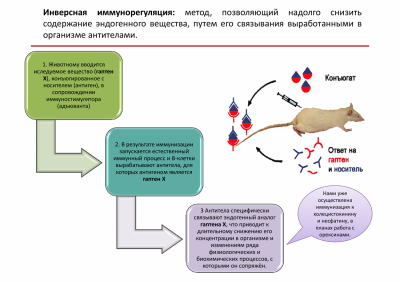
Для создания долговременных моделей депрессивных и тревожных состояний используется метод инверсной иммунорегуляции, состоящий в индукции аутоантител к эндогенным регуляторам. Специфическое связывание антителами избранного эндогенного регулятора приводят к изменению его концентрации и стойким изменениям ряда физиологических и биохимических процессов, с которыми сопряжён данный регулятор. Метод позволяет на очень длительное время (месяцы) целенаправленно изменять разнообразные физиологические процессы в организме.
Также отработаны ноцицептивные модели, включая фармакологическую модель мигрени (мыши), модель расстройства пищевого поведения. Для верификации поведенческих результатов мы используем биохимические и молекулярные методы: выделение РНК, обратная транскрипция, полимеразная цепная реакция в реальном времени, иммуноферментный анализ, ВЭЖХ. В сотрудничестве с группой медицинской и ветеринарной генетики кафедры генетики Биофака МГУ активно проводится поиск транскрипционных мишеней пептидных регуляторов, анализ и ре-анализ литературных данных и построение сигнальных путей. Использование всех перечисленных подходов позволяет эффективно решать поставленные задачи.
Ключевые статьи: 1. Rudko Olga I., Tretiakov Artemii V., Naumova Elena A., Klimov Eugene A. Role of PPARs in Progression of Anxiety: Literature Analysis and Signaling Pathways Reconstruction. // PPAR Research, издательство Hindawi Publishing Corporation (United States), 2020, том 2020, с. 1-15 2. Tretiakov A., Malakhova A., Naumova E., Rudko O., Klimov E. Genetic Biomarkers of Panic Disorder: a Systematic Review. // Genes, издательство Molecular Diversity Preservation International (MDPI) (Basel, Switzerland), 2020, том 11, № 11, с. 1-22 3. Соболев В.В., Третьяков А.В., Рудько О.И., Соболева А.Г., Данилин И.Е., Корсунская И.М., Климов Е.А. Психодерматология: молекулярная общность псориаза и тревожного расстройства. // Эффективная фармакотерапия, издательство Общество с ограниченной ответственностью Медфорум (Москва), 2017, № 2(15), с. 10-14 4. Kondratieva N., Azimova J., Skorobogatykh K., Sergeev A., Naumova E., Kokaeva Z., Anuchina A., Rudko O., Tabeeva G., Klimov E. Biomarkers of migraine: Part 1 – Genetic markers. // Journal of the Neurological Sciences, издательство Elsevier BV (Netherlands), 2016, том 369, с. 63-76 5. Шипилова А.А., Тарасова А.Ю., Скобелева В.М., Климов Е.А., Ловать М.Л., Кокаева З.Г., Рудько О.И. Холецистокинин как экспрессионная мишень Несфатина-1 в процессах формирования пищевого поведения. // Медицинская генетика, издательство Гениус Медиа (М.), 2015, том 14, № 4, с. 45-45 6. Ashmarin I.P., Danilova R.A., Rudko O.I., Belopolskaya M.V., Obukhova M.F., Shmalgausen E.V. Induction of autoimmunity against endogenous neuroregulators isatin and cholecystokinin as a method of modeling and correction of depressive behavior. // Neurochemical Journal, издательство Maik Nauka/Interperiodica Publishing (Russian Federation), 2007, том 1, № 2, с. 133-137 7. Данилова Р.А., Рудько О.И., Короткова Т.М., Обухова М.Ф., Ашмарин И.П. Влияние иммунизации к фрагменту ХЦК 30-33 на поведение белых крыс. // Российский физиологический журнал им. И.М.Сеченова, издательство Наука (СПб.), 2000, том 86, № 9, с. 1167-1174 С полными текстами и другими работами можно ознакомиться по ссылке: http://istina.msu.ru/profile/olga-ru/ |
© 2026 Кафедра Высшей нервной деятельности МГУ |
|
|